粒子治疗系列报道(1):人体在带电粒子暴露时分子信号通路的变化
【译者简介】:夏启胜,北京协和医学院分子生物学博士,中日友好医院临床医学研究所助理研究员。主要研究方向:肿瘤生物学与物理治疗。参加“肿瘤磁感应加温治疗新方法的若干关键技术”等国家自然科学基金项目,在Oncogene、Pancreas、Oncology reports等杂志以第一作者发表多篇文章。
【背景】放射治疗是一种重要的肿瘤治疗方法,主要分为光子线和粒子线两种(图1)。
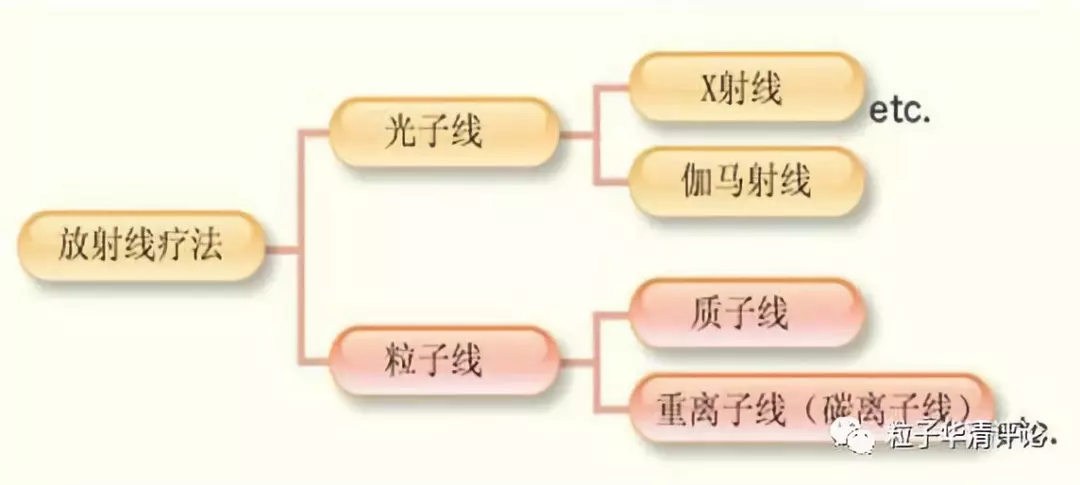
图 1 放射治疗方法的分类
高能带电粒子在穿过健康组织和肿瘤组织时,会引发一系列的DNA损伤反应(DNA Damage Response,DDR)。在暴露于高线性能量转移(LET)带电粒子后,复杂的DNA损伤导致DNA修复灶的形成,这通常在几秒钟内便开始出现。与低LET相比,高LET照射后会发生更多的蛋白修饰。带电粒子暴露可激活多种具有细胞保护作用或细胞破坏作用的细胞因子,或上调细胞因子和趋化因子的表达,并参与旁观者信号的转导。在不同的肿瘤类型和健康组织中,有必要决定细胞生存或死亡的分子信号应作为形成放射致敏和保护进行充分研究。在接触带电粒子的动物的各种组织中也发现了长期信号和基因表达的变化,阐明这些信号通路的变化在带电粒子治疗的慢性和晚期效应中的作用将有助于制定更有效的治疗措施。
在放射治疗中,高能带电粒子由于其良好的剂量分布,主要表现为存在布拉格(Bragg)峰在确定的线性能量转移(LET)范围内具有更好的保留健康组织和更高的生物效率(图 2)。
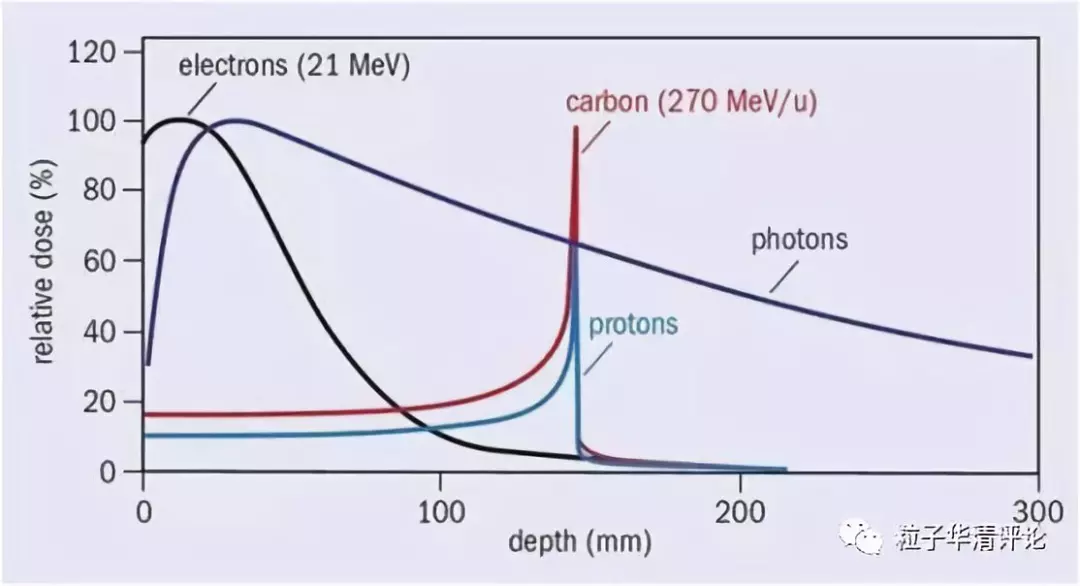
图 2 各种射线照射时剂量分布,碳离子和质子均存在明显的布拉格峰
高LET辐射比低LET辐射具有更强的DNA破坏能力,可以更有效的杀伤细胞或抑制增殖。低LET辐射和高LET辐射的一个主要区别是微观剂量沉积。带电粒子沿着电离轨道沉积能量。在这些轨道内的染色体中,会产生复杂的损伤,一般定义为2个或更多的脱碱基位点,碱基氧化、位于相对的链或同一条链上的DNA单链或双链断裂(图3)图3。
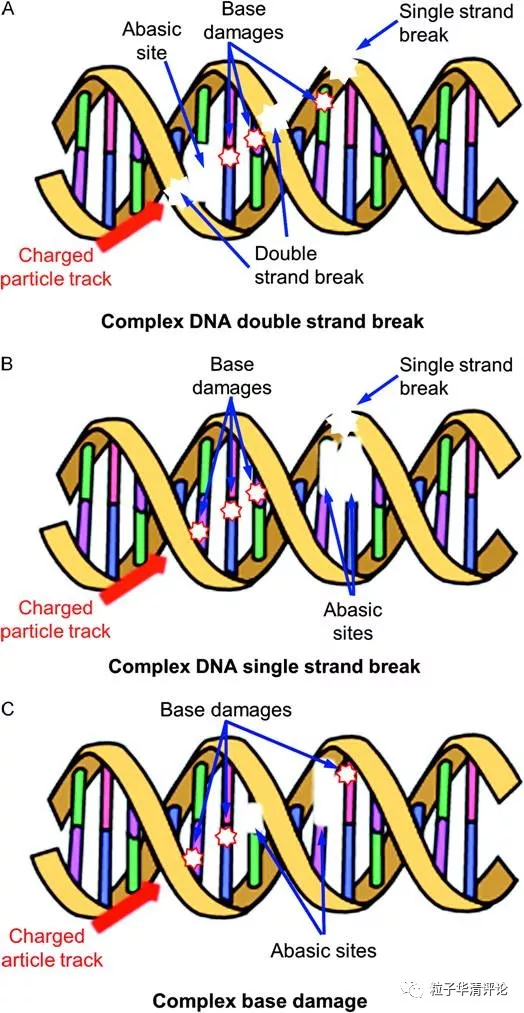
图 3 带电粒子暴露后复杂的DNA损伤,出现脱碱基、碱基损伤、单链或双链断裂
这种DNA损伤很难被修复,并且会影响DNA修复的忠实性。DNA修复系统在处理复杂损伤方面存在固有缺陷。针对带电粒子暴露的分子信号主要是一种DNA损伤反应(DDR),导致细胞转向存活或死亡(图4)。
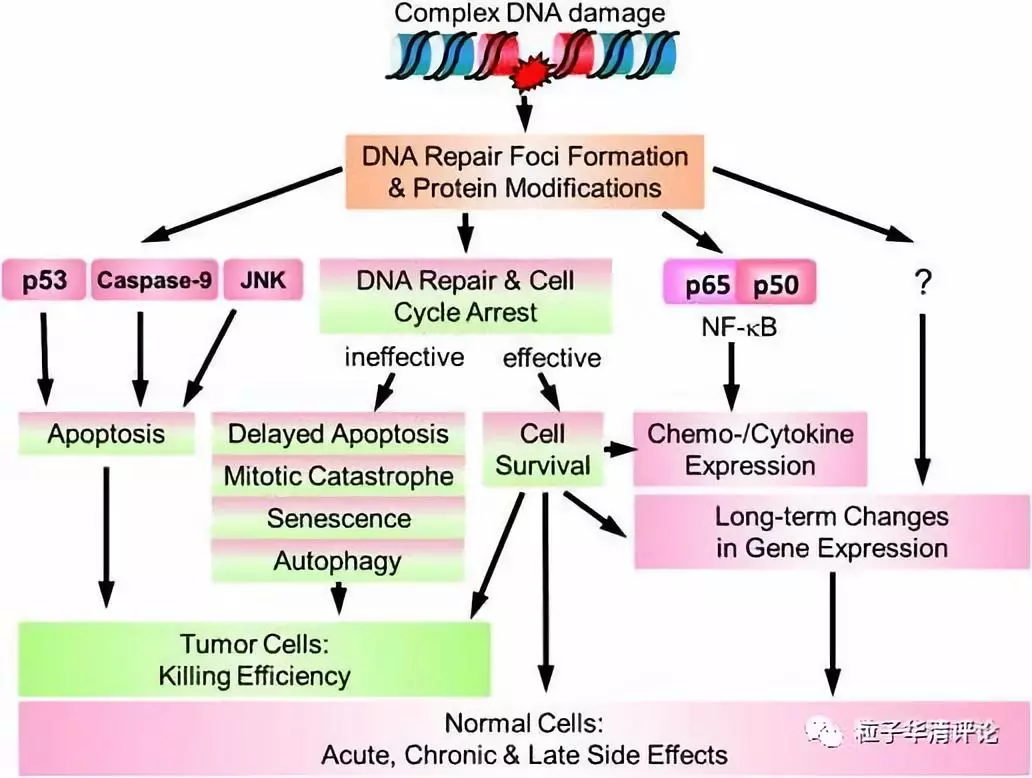
图4 带电粒子暴露后激活的信号通路与结果
然而,复杂的DNA损伤在更有效地损伤肿瘤细胞的同时也可以损伤健康细胞。在存活的细胞中,复杂的DNA损伤导致长期的信号通路和基因表达的改变,这可能是导致肿瘤促进和/或退行性疾病的一些因素。
【小结】
本文总结了目前关于带电粒子照射后分子信号的研究现状,并重点比较带电粒子照射后分子信号与低LET照射后在数量和质量上的差异性。
1、带电粒子暴露后的细胞内分子信号
电离辐射诱导多种基因毒性、诱导应激信号通路,调控细胞生长、增殖、细胞周期进展、DNA复制、DNA修复、细胞死亡、凋亡和细胞粘附等。DDR信号网络通过细胞周期检查点和DNA修复来确保细胞基因组的完整性。DDR基因还参与转录调控和染色质重塑。
2、DNA修复灶形成
电离辐射激活PI3K(磷脂酰肌醇-3激酶相关酶)信号通路,包括共济失调毛细血管扩张突变体(ATM)、共济失调毛细血管扩张症、rad3相关蛋白(ATR)和DNA依赖蛋白激酶(DNA-PK)。ATM和ATR被募集到复杂的双链断裂(DSBs)处。与野生型动物相比,ATM单倍体功能不全的小鼠发生白内障的时间更早,而且与低LET X射线相比,高LET重离子放射敏感性增加的更多。快速招募的蛋白质一般负责损伤识别,而较慢积累的蛋白质主要参与随后的修复事件。
3、蛋白质的修饰
与低LET辐射相比,高LET辐射通过翻译后和氧化过程导致更多的蛋白质修饰。泛素/蛋白酶体系统可能通过影响蛋白周转来调节细胞辐射反应,并与H2AX、p53、adp -核糖基化等泛素样修饰物的磷酸化、甲基化、乙酰化等作用。
除了快速磷酸化,其他一些动力学较慢的蛋白质修饰,如泛素化,也有报道。最近的一项HeLa宫颈癌和口咽鳞状细胞癌的研究表明高剂量(10 Gy) 高-LETα-粒子(LET 121 keV /μm)和质子(LET 12 keV /μm)辐照后几个小时开始出现组蛋白H2B赖氨酸-120 (H2B ub)处泛素化,但低LET质子(1 keV /μm)或x射线/γ-射线无此现象。
4、信号通路和基因表达变化
碳离子(LET 30/70keV/μm )和铁离子(LET 180 keV /μm)暴露可杀死淋巴细胞系细胞,且独立于p53 通路。高LET (> 70 - 85 keV /μm)重离子辐射诱导的, 不依赖于p53细胞凋亡可能是由线粒体相关凋亡通路包括caspase-9、胞质丝裂原活化蛋白激酶(MAPK)通路,细胞外c-Jun、 JNK通路激活。
在决定受辐照细胞的命运方面,DDR也起着同样重要的作用。此外,A549细胞暴露于1 Gyγ-射线后ERK出现磷酸化,但碳离子辐照后(LET 290 keV /μm)无此现象,而是出现JNK暂时性的磷酸化。说明碳离子照射后主要激活前凋亡因子。重离子束抑制丝氨酸/苏氨酸激酶B (AKT)的生存信号通路,可能增强caspase对碳离子诱导的自噬和凋亡的激活。DDR可激活多种转录因子。人体细胞NF-κB通路可被重离子LET 70到300 keV /μm强烈激活,但不能保护细胞免受重离子诱导的细胞死亡,但同X射线相比,它确实引起更强的一些细胞因子和趋化因子的表达。辐射量被认为是细胞信号和整体基因表达变异的最重要的影响因素。
【文献】
Hellweg CE, Chishti AA, Diegeler S, et al. Molecular Signaling in Response to Charged Particle Exposures and its Importance in Particle Therapy [J]. International Journal of Particle Therapy,2018,5 (1):60-73.

长按识别二维码 关注我们

